Initiation aux méthodes intégrées au Jardin Potager
Analyse de laboratoire d’un sol de culture
Autres données intéressantes susceptibles de figurer dans un rapport d’analyse
Merci de bien vouloir partager ce site internet avec vos proches et tous ceux qui sont intéressés par les méthodes intégrées en agriculture.
La Réserve Utile en eau (RU) d’un sol de culture
Après un arrosage intensif, l’eau occupe la totalité des petites cavités situées entre les éléments du sol. Après le ressuyage qui permet un travail à sec, il reste encore de l’eau dans les microspores inférieures à 30 microns alors que les macrospores sont remplies d’air. Le point de rétention est la quantité d’eau qu’un sol peut emmagasiner lorsqu’il est ressuyé. S’il n’y a pas d’autre arrosage, le sol continue de perdre de l’eau.
Au-delà d’une certaine limite d’assèchement, les plantes ne sont plus capables d’extraire l’eau et commence à flétrir. La réserve utile (ou réserve facilement utilisable) est celle comprise entre le point de rétention d’eau et le point où apparaît le flétrissement permanent. La capacité de rétention de l’eau varie en fonction de la structure du sol. Plus la texture du sol est fine, plus la réserve utile est élevée (plus le sol peut contenir de l’eau). Elle est 80L/m3 pour un sol sableux et de 300L/m3 pour un sol argileux. Une capacité de rétention faible nécessite de fractionner davantage les apports d’engrais solubles pour éviter qu’ils ne soient entraînés en profondeur. La connaissance de la réserve utile permet aussi de prévoir quand il est nécessaire de procéder à un arrosage et les périodes d’arrosage.
Teneur en carbone organique d’un sol de culture
Le dosage du carbone organique du sol sert à apprécier le taux de matière organique totale présent dans le sol. Il existe plusieurs méthodes d’analyses par combustion ou voie humique pour effectuer le dosage en carbone. On estime que le rapport matières organiques/carbone est à peu près constant. Le carbone ne représente qu’une fraction de la matière organique. Dans les analyses de laboratoire, un facteur multiplicateur est appliqué pour tenir compte des éléments présents dans la matière organique autre que le carbone, notamment l’oxygène et l’azote.
Le taux de matière organique est obtenu en multipliant la teneur en carbone organique par un coefficient correctif généralement compris entre 1,7 et 2 selon le laboratoire. Le coefficient 1,7 est le plus couramment utilisé. La teneur en carbone organique (Corg ou C dans certaines analyses de labo) est exprimée en % de terre analysée. D’autres laboratoires appliquent des facteurs correctifs différents pour passer de la quantité de carbone organique à la teneur en matière organique selon la nature du sol. Par exemple, pour un sol à humus de type MOR, le facteur de correction peut être de 1 ,77 à 1,93.
Mesure des réserves en phosphore d’un sol de culture
Différentes méthodes de dosage sont utilisées en fonction du pH du sol. La méthode Joret-Heber consiste en une extraction du phosphore assimilable à l’oxalate d’ammonium en milieu neutre. La méthode Joret-Heber est considérée comme satisfaisante bien qu’elle donne un résultat inférieur (environ 1/3) à la méthode Dyer qui est la plus agressive. Avec la méthode Joret-Heber, l’optimum se situe entre 151 à 280, alors que dans la méthode Dyer l’optimum est estimé entre 280 à 400. La méthode Olsen utilise un réactif (bicarbonate de sodium) qui donne des valeurs plus faibles que les deux méthodes précitées.
Fertilisation ; mesure de quelques oligo-éléments

Les oligo-éléments sont dosés en mg par kg de matière sèche selon la méthode d’extraction DTPA (norme AFNOR NF X 31-121). Si les mesures montrent une carence en oligo-élément, celle-ci se corrige très facilement par des engrais foliaires spécifiques agissant directement sur les plantes (a). On peut trouver dans des livres et sites internet des descriptifs de carence d’oligo-éléments utilisant de simples observations visuelles ce qui n’est pas la meilleure des méthodes en raison du risque de confusion entre carence réelle ou induite. Et c’est encore plus vrai quand il existe plusieurs carences. Seules les analyses de laboratoire permettent de mettre en évidence avec une bonne précision l’existence et l’origine d’une ou plusieurs carences.
a) L’apport d’engrais foliaire est peu efficace par temps sec.
Pour en savoir plus sur les oligo-éléments et la fertilisation, cliquer ici
Mesure de quelques éléments majeurs d’un sol de culture
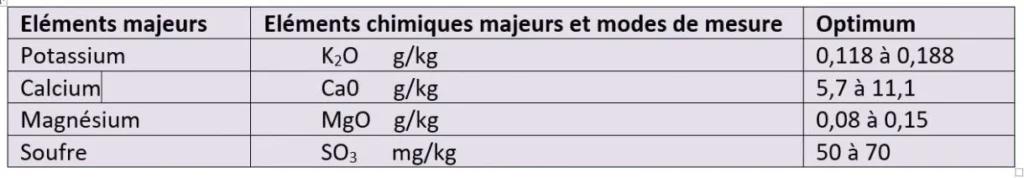
Les différents éléments majeurs sont évalués en g par kg de terre ou en mg par kg de terre.
Fertilisation et rapports spécifiques potassium, magnésium, calcium

Les mesures doivent au moins préciser deux rapports :
- Entre le potassium et le magnésium,
- Entre le calcium et le magnésium
et cela afin de savoir s’il n’y a pas de risque de carence induite.
Sol de culture, mesure du calcaire total et libre
Mesurer le calcaire total consiste à déterminer la quantité de calcaire présent dans le sol comprenant la fraction la moins soluble dans l’eau. Une partie du calcaire est facilement attaquable par l’acide carbonique présent dans l’eau de pluie ou par les acides organiques du sol pour former du bicarbonate de calcium soluble produisant des ions calcium (Ca²+). Cette fraction de calcaire est dénommée calcaire actif ou libre comprenant également d’autres molécules comme le nitrate de calcium ou les phosphates monocalciques.
Quand les cations Ca²+ sont trop abondants, ils ont tendance à saturer les complexes absorbants. Les analyses de laboratoire permettent de préciser la quantité de calcaire présent dans la solution du sol et la quantité d’ions calcium fixés par les complexes absorbants. Pour autant, le calcaire actif est loin d’être nocif tant qu’il reste incorporé à l’eau du sol, car il maintient la coagulation de l’argile. Ce n’est que lorsqu’il entre en contact avec les racines pour former un manchon asphyxiant réduisant l’absorption du fer que le calcaire devient toxique. En arboriculture, la connaissance du calcaire actif est indispensable pour juger de l’aptitude fruitière d’un sol. Les normes de tolérances sont de 15 % pour le cerisier, 10 % pour le pommier, 6 à 8 % pour le poirier et moins pour le pêcher qui est l’espèce fruitière la plus sensible (1). Pour les légumes dont la plupart sont calcicoles, un sol riche en calcaire sous réserve qu’il soit correctement pourvu en humus, n’est pas très préoccupant. Pour autant, l’apport de matières organiques dans un sol très calcaire peut avoir un effet pervers quand ces matières organiques contiennent des acides humiques qui vont dissoudre le calcaire et augmenter sa solubilité. Pour éviter cet inconvénient, un sol trop calcaire doit être amendé en argile avant de recevoir de la matière organique.
Une autre forme de calcaire, le gypse (CaSO⁴) favorise la croissance des plantes quand sa teneur dans le sol est de 2 à 25 %. Au-delà, le gypse peut causer des réductions considérables de rendements des cultures. Dans les sols à dominante de calcaire actif, il faut exclure tous les apports qui pourraient l’augmenter quand cela ne convient pas aux plantes cultivées.
Au-delà de 5 % de calcaire total se traduisant par un sol systématiquement basique, les réserves naturelles de calcium et leur libération progressive par dissolution rend inutile un apport de calcaire rapide comme le chaulage. La détermination du calcaire actif permet de définir l’Indice du Pouvoir Chlorosant (IPC) qui est une estimation des risques de carence en fer. Un sol pauvre en fer libre contenant du calcaire actif peut se traduire par un défaut d’assimilation du fer (chlorose ferrique). Certaines plantes comme les fraisiers, la vigne, certains arbres fruitiers comme les pommiers sont sensibles à ce type de carence. Lorsque le calcaire actif est inférieur à 4 %, le risque d’une chlorose ferrique est très faible. Une teneur en calcaire actif supérieur à 6 % induit un risque de chlorose ferrique significatif qui devient très important quand la teneur dépasse les 10 %.
Autres mesures
En fonction du type d’agrément délivré, certains laboratoires peuvent produire d’autres analyses notamment sur les éléments traces (Cadmium, chrome, cuivre, nickel, plomb, zinc, mercure) ou utiliser des méthodes plus précises concernant le prélèvement et la conservation des échantillons de sol en vue de la détermination de l’azote minéral sur sol frais. Ces analyses doivent être entreprises quand on suppose qu’un sol de culture récemment acquis contient des polluants, ou quand on désire connaître simplement la teneur en certains oligoéléments.
1) Le thème de l’eau dans la vallée du Rhône – essai sur la genèse d’un espace hydraulique – J Bhetemont – 1972
