Les complexes argilo-humiques.
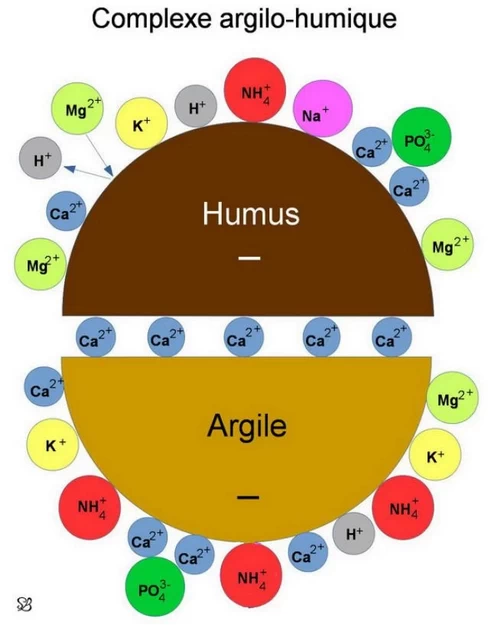 Certains éléments de l’humus, notamment les acides humiques gris et des humines, ont la faculté de se lier à l’argile pour former des Complexes Argilo-Humiques (CAH) connus pour être très stables. Les micelles d’argile et les molécules d’humus électronégatives sont reliées entre eux le plus souvent par des cations de calcium. Ce type de liaison freine la minéralisation de l’humus. La stabilisation de l’ensemble est d’autant plus grande quand les composés humifères sont polycondensés favorisé par des conditions du sol ni trop acides ni trop basiques (1). Ces agrégats jouent un rôle important dans la structuration des sols en ménageant entre eux des espaces lacunaires remplis d’air et d’eau.
Certains éléments de l’humus, notamment les acides humiques gris et des humines, ont la faculté de se lier à l’argile pour former des Complexes Argilo-Humiques (CAH) connus pour être très stables. Les micelles d’argile et les molécules d’humus électronégatives sont reliées entre eux le plus souvent par des cations de calcium. Ce type de liaison freine la minéralisation de l’humus. La stabilisation de l’ensemble est d’autant plus grande quand les composés humifères sont polycondensés favorisé par des conditions du sol ni trop acides ni trop basiques (1). Ces agrégats jouent un rôle important dans la structuration des sols en ménageant entre eux des espaces lacunaires remplis d’air et d’eau.
Les CAH sont également appelés « complexes adsorbants », expression qui regroupe d’autres substances ayant la faculté de retenir à leur surface des ions présents dans la solution du sol. Plus les micelles d’argile sont fines, plus leur capacité de rétention est grande ce qui favorise la stabilité des liaisons avec l’humus. Les surfaces des CAH chargées en électricité négative attirent les ions chargés en électricité positive (cations). Parmi les cations fixés par les CAH, les cations Mg₂⁺ (magnésium), K⁺ (potassium), Ca₂⁺ (calcium), Na⁺ (sodium), NH₄⁺ (ammonium), qui sont des nutriments pour les plantes, sont également retenus. C’est pour cette raison que les CAH sont considérés comme des réservoirs de nutriments.
Les CAH sont déclarés saturés quand tous les cations H⁺ sont remplacés par d’autres cations. Dans les sols habituellement étudiés, la proportion de cations fixée dans les complexes argilo-humiques est souvent celui-ci : Ca₂⁺ = 75 à 90 %, Mg₂⁺ = 10 à 30 %, K⁺ et NH₄⁺ = 5 à 10 %, Na⁺ = 2 à 5 % (3).
Des liaisons faibles dans les CAH qui permettent des échanges de cations avec les racines.
Les liaisons entre les CAH et les cations sont suffisamment faibles permettant aux cations d’être retenus sous une forme échangeable. Plus précisément, un cation ne peut être libéré dans une solution que s’il existe un autre cation capable de le remplacer et si la force de liaison de ce dernier avec le complexe absorbant est plus forte que celle du cation déjà fixé. Les CAH absorbent les cations dans un ordre d’affinité décroissante qui est celui-ci : Ca₂⁺> Mg₂⁺> K⁺> NH₄⁺> Na⁺> (3). Les échanges ont lieu jusqu’à ce que l’équilibre électrique du milieu soit atteint. Ainsi, l’absorption par les racines des plantes des cations fixés sur les CAH n’est possible que si d’autres cations les remplacent. Ces échanges ont lieu au niveau des radicelles.
Un milieu acide détruit les liaisons des complexes argilo-humiques.
Dans un milieu acide, les cations H⁺ ont tendance à remplacer les autres cations y compris les cations Ca₂⁺ qui lient l’humus et l’argile ce qui entraîne une déstructuration du complexe absorbant. Pour éviter cette déstructuration des CAH dans les sols pauvres en calcium, il faut apporter des amendements calciques rapides dès que possible. La chaux permet de neutraliser rapidement une terre trop acide, mais elle est interdite en agriculture biologique.
La fixation de l'azote par les complexes argilo-humiques.
Les nitrates et les chlorures ne sont pas retenus par les complexes adsorbants. Par contre les ions ammonium (NH₄⁺) sont absorbés ce qui a pour avantage de former une réserve en azote assimilable par les plantes. Il est utile de rappeler que l’assimilation de l’azote par les plantes s’effectue de deux manières :
Absorption des nitrates solubles dans l’eau du sol produits par la décomposition des matières organiques et des engrais azotés industriels (urée, ammonitrate…). Les nitrates sont la source d’azote la plus utilisée par les plantes.
Absorption de l’ammoniac par des échanges d’ions entre les radicelles et les complexes argilo-humiques situés à leur contact. C’est la seule forme d’absorption de l’ammoniac par les plantes. Cette fixation de l’ammoniac par les CAH a pour avantage de limiter les pertes de cette forme d’azote par volatilisation.
Le fait que les nitrates très solubles ne peuvent être fixés sur les CAH, constitue un problème majeur dans le contrôle de la fertilisation de l’azote surtout en agriculture biologique qui interdit de réguler les besoins des plantes par un apport précis en sels minéraux azotés (voir l’article : la problématique de l’assimilation de l’azote en agriculture biologique). D’autre part, les cations ammonium sont en concurrence avec d’autres éléments (notamment le calcium et le magnésium) réduisant le stock de cations d’ammonium fixé par les CAH. Ainsi le stock d’ammonium est souvent insuffisant pour satisfaire les besoins des plantes dans les périodes les plus critiques.
Complexes argilo-humiques et réduction des pertes d'éléments solubles provenant des engrais.
Si la solution du sol est modifiée par l’apport d’engrais contenant des éléments solubles dans l’eau, certains cations (Ca₂⁺, H⁺…) quitteront le complexe argilo-humiques pour être remplacés par d’autres cations provenant de ces engrais (sauf les nitrates). Il est évident que ces propriétés sont très importantes en matière de fertilisation. Le mode de fixation de ces nutriments par les CAH évite que ces nutriments ne soient perdus par lessivage ou lixiviation.
Dans les sols très calcaires, on constate souvent une teneur élevée de calcaire soluble dans l’eau qu’accélère encore le CO₂ produit par une forte activité biologique consécutive à un apport de matières organiques. Ce calcium finit par saturer les complexes argilo-humiques au détriment des autres cations comme le potassium et le phosphore qui peuvent alors faire défaut. C’est pour cette raison que les sols trop calcaires ont du mal à retenir les engrais minéraux. Pour réduire cette influence du calcaire, il faut apporter des amendements argileux dont les modalités sont décrites ici.
 Certains éléments de l’humus, notamment les acides humiques gris et des humines, ont la faculté de se lier à l’argile pour former des Complexes Argilo-Humiques (CAH) connus pour être très stables. Les micelles d’argile et les molécules d’humus électronégatives sont reliées entre eux le plus souvent par des cations de calcium. Ce type de liaison freine la minéralisation de l’humus. La stabilisation de l’ensemble est d’autant plus grande quand les composés humifères sont polycondensés favorisé par des conditions du sol ni trop acides ni trop basiques (1). Ces agrégats jouent un rôle important dans la structuration des sols en ménageant entre eux des espaces lacunaires remplis d’air et d’eau.
Certains éléments de l’humus, notamment les acides humiques gris et des humines, ont la faculté de se lier à l’argile pour former des Complexes Argilo-Humiques (CAH) connus pour être très stables. Les micelles d’argile et les molécules d’humus électronégatives sont reliées entre eux le plus souvent par des cations de calcium. Ce type de liaison freine la minéralisation de l’humus. La stabilisation de l’ensemble est d’autant plus grande quand les composés humifères sont polycondensés favorisé par des conditions du sol ni trop acides ni trop basiques (1). Ces agrégats jouent un rôle important dans la structuration des sols en ménageant entre eux des espaces lacunaires remplis d’air et d’eau.