Le pH (potentiel hydrogène) décrit le taux d'acidité ou d’alcalinité de la solution du sol qui dépend de la concentration en ion hydrogène. Les sols sont considérés comme :
Moyennement acides quand le pH est inférieur à 6, et très acide quand le pH est inférieur à 5.
Moyennement basiques (alcalins) quand le pH est supérieur à 8 et très basiques quand le pH est supérieur à 9.
Un sol pauvre en calcaire a tendance à s’acidifier (pH < 7). Un sol riche en calcaire est plutôt basique (pH > 7).
La valeur du pH du sol a une action importante sur la biomasse. Des modifications importantes de la valeur du pH peuvent se traduire par une diminution de la biomasse bactérienne dont le volume peut être divisé jusqu’à 30.
Un sol est naturellement propice à une acidification quand il repose sur un substrat granitique, schisteux ou sableux. L’acidification est aussi un processus naturel en climat tempéré qui s’accélère en saison pluvieuse. Au fil du temps les sols de culture s’acidifient suite à la nitrification de l’ammonium provoquée par des bactéries quand des engrais azotés synthétiques (contenant de l'urée, du nitrate d'ammonium, du sulfate d'ammonium…) ou organiques (fumiers, composts) sont ajoutés au sol. À noter que le nitrate de potasse ou de soude, le phosphate bicalcique et la cyanamide calcique ont un effet alcalinisant quand ils sont utilisés seuls.
L’acidification est aussi plus élevée en hiver. Un milieu très humide et non aéré favorise la production d’acides organiques. Un sol acide produit plus facilement une accumulation de matières organiques non décomposée facilitant l’émergence de maladies sur les végétaux.
Solution basique ou acide ; quelle est la différence ?
Toute solution comprenant de l’eau et un corps dissous (soluté) est dénommée solution aqueuse. Tous les sels dissous dans l’eau sont sous une forme ionique. Les solutions aqueuses ioniques contiennent des ions portant une charge d’électricité négative (anions) et des ions portant une charge d’électricité positive (cations). Une solution est neutre quand elle contient autant d’anions que de cations. Un excès de cations hydrogène H+ est responsable de l’acidité d’une solution. Quand les anions hydroxyde OH- sont plus nombreux, la solution est basique (alcaline).
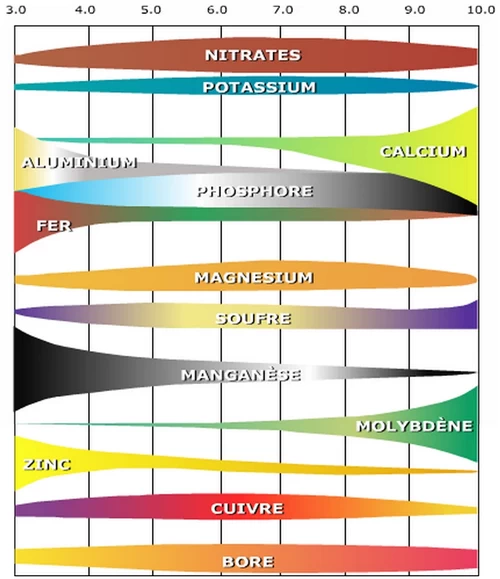
Ce diagramme montre l’impact du pH sur la disponibilité des éléments nutritifs et l’émergence de la toxicité de certains métaux (notamment aluminium)
Source : Université Nice-Sophia Antipolis
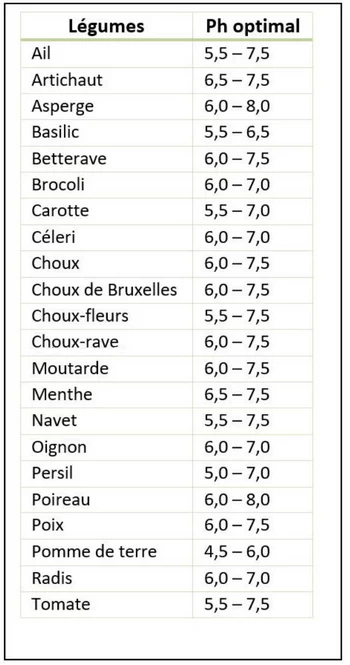
pH optimal d'Absorption pour quelques légumes
pH et absorption des éléments nutritifs présents dans le sol
L’absorption de certains éléments nutritifs par les plantes dépend de deux facteurs liés au pH du sol :
Le pH optimal du sol pour l'absorption de chaque élément nutritif : Chaque élément nutritif a un pH optimum de disponibilité pour les plantes.
Le pH d'absorption optimale des éléments nutritifs pour chaque plante : Le pH optimum d’absorption varie selon la nature des cultures. Pour les cultures calcicoles, on aura une meilleure absorption des éléments nutritifs quand le pH est supérieur à 8. Pour les cultures acidophiles, un pH inférieur à 6,5 est préférable.
En agronomie, on considère que le potentiel de fertilité n’est pas affecté quand le pH se situe dans une plage entre 6,5 (légèrement acide) à 7,5 (légèrement alcalin). La plupart des éléments nutritifs sont absorbés de façon optimale par les plantes dans cette plage de pH qui est aussi compatible avec la croissance de leurs racines. L’activité de la microflore est plus intense en milieu neutre. Au voisinage de la neutralité (pH 7), la conversion microbienne de l’ammoniac en nitrate est rapide. Un pH neutre favorise également la dégradation des produits phytosanitaires.
Un pH inférieur à 5 produit un excès d’absorption d’aluminium qui est toxique pour les plantes ; un risque évalué seulement à 1 % pour les sols français. (1)
L’assimilation par les plantes de l’azote, du Potassium et du soufre semble être moins affectée par le pH du sol. Par contre, l’assimilation du phosphore est plus affectée par la valeur du pH du sol. La plupart des autres nutriments (oligo-éléments en particulier) ont tendance à être moins disponibles quand le pH du sol est supérieur à 7,5, alors qu’ils sont parfaitement disponibles lorsque le pH est légèrement acide de 6,5 à 6,8. Le molybdène (Mo) fait exception étant moins disponibles avec un pH acide et il est plus disponible avec des valeurs de pH modérément alcalin ce qui convient très bien à la culture du concombre.
Le pH du sol joue un rôle important dans les pertes par volatilisation de l’ammoniac. Un engrais azoté comme l'urée est généralement soumis à des pertes plus importantes avec un pH de 8. Toutefois, il existe d'autres facteurs tels que l'humidité du sol, la température, la texture et la capacité d'échange cationique qui peuvent affecter la volatilisation de l’ammoniac. Le point important à retenir c’est que dans des conditions de faible humidité du sol ou une mauvaise incorporation d’un engrais, la perte par volatilisation peut être considérable même si le pH descend à une valeur aussi basse que 5,5.
Le pH du sol est un facteur important dans la fixation de l’azote chez les légumineuses. La survie et l'activité de la bactérie Rhizobium (responsable de la fixation de l’azote en association avec des légumineuses) diminuent quand l'acidité du sol augmente. Ceci est à prendre en considération lorsque l'on tente de cultiver des légumineuses (haricots, petits pois…) sur des sols dont le pH est inférieur à 6.
En culture maraîchère, un pH de 8 n’empêche pas d’obtenir des récoltes acceptables, y compris pour la pomme de terre qui, en principe, préfère les sols légèrement acides. Dans la vallée de la Durance, il existe de nombreux agriculteurs qui produisent différentes variétés de pommes de terre alors que leurs sols de culture sont riches en calcaires avec un pH d’environ 8. En général, ces agriculteurs doivent faire face à des problèmes bien plus impactant comme la pression des bioagresseurs (en particulier le doryphore et la larve du taupin).
Tenant compte de tous ces éléments évoqués plus haut, une valeur neutre est une bonne moyenne pour l’ensemble des cultures. C’est cette valeur que le jardinier amateur doit rechercher par l’apport d’amendements appropriés.
Attention à l’effet alcalinisant de la cendre de bois :
La cendre de bois qui contient beaucoup de potasse et de calcium a un effet alcalinisant. Son action est très rapide et il faut en tenir compte quand on la répand sur des cultures (ou si on l’incorpore dans un compost). Dans les régions où le sol est riche en calcaire et dans l’espoir d’améliorer sa fertilité, certains jardiniers amateurs répandent de la cendre de bois dans leur jardin alors que leur sol est déjà alcalin. Bien entendu, cet apport qui augmente le pH du sol peut avoir des conséquences graves sur la biodiversité du sol et produire des carences induites d’autres éléments. L’apport de cendre de bois ne devrait pas dépasser 15 kg pour 100 m².
Astuce :
La cendre de bois contient de la potasse qui est très soluble. Il n’est donc pas judicieux de la répandre en hiver. Dès les premières pluies, la potasse sera emportée vers la nappe phréatique. Il est préférable d’ajouter la cendre de bois par grattage dans les premiers cm du sol juste avant la mise en place des cultures.
Mesure du pH à la portée du jardinier amateur
Le test du vinaigre est quelquefois évoqué sur des sites internet (2) pour déterminer si le sol est acide ou alcalin. En réalité, il met surtout en évidence la présence de calcaire dans le sol et ne donne aucune précision sur la valeur du pH, ni du calcaire libre encore dénommé calcaire actif présent dans la solution du sol (qu’il ne faut pas confondre avec le calcaire total dont une partie est sous forme solide). Il n’est pas nécessaire de s’adresser à un laboratoire pour connaître à chaque fois le pH du sol. Il existe des outils électroniques ou d’analyses chimiques à la portée du jardinier amateur permettant de mesurer le niveau d’acidité ou d’alcalinité du sol.
Testeurs de pH électroniques compatibles pour les activités agricoles
Testeur pH Adwa avec les solutions de calibrage
Il existe de nombreux modèles de testeurs de pH à tous les prix (ils sont aussi utilisés en aquariophilie, pour les piscines…). La plupart de ces testeurs doivent être calibrés à l’aide de solutions. Certains testeurs peuvent être calibrés avec une seule solution (pH neutre) ce qui est largement suffisant en agriculture. Le coût d’acquisition pour un testeur de premier prix est environ 40 € avec les piles et les solutions de calibration. Pour un prix légèrement supérieur, il est possible d’acquérir un modèle avec sonde remplaçable par exemple en cliquant ici où les sondes sont livrées calibrée. On peut aussi commander les piles de rechange et des sachets de solutions pour la calibration qu’il faut en principe refaire toutes les semaines. Ne pas acheter de testeur dans un magasin qui ne fournit pas les solutions de calibration. Une traduction de la notice écrite en anglais pour les testeurs AD100 et 101 est disponible ici.
Papier pH de laboratoire compatible pour les activités agricoles
Il existe des bandes de papier-pH imprégnées avec un réactif qui se colore différemment en fonction de la valeur du pH disponible ici.